Obecnie żyjemy w okresie intensywnego rozwoju nauki zwanej nanotechnologią, blisko powiązanej z chemią koloidów.
Średnia wielkość cząstek tworzących dany koloid mieści się zazwyczaj w przedziale 1-1000 nm (1 nm = 10-9 m). Dzięki małemu rozmiarowi, nanocząstki takie mogą tworzyć stabilne roztwory koloidalne, co jest ważne w przypadku zastosowań biologicznych, znakowania czy w inżynierii materiałów. Aktualnie można znaleźć wiele definicji nanocząstek. Jedna z nich mówi, że gdy dany materiał składa się z cząstek, których przynajmniej jeden z trzech wymiarów przestrzennych jest mniejszy niż 100 nm, to może on nosić miano nanomateriału. Inna definicja mówi, że określony produkt może nosić miano nanomateriału, gdy po "miniaturyzacji"
do rozmiarów nanometrycznych następują zmiany jego właściwości fizykochemicznych w porównaniu do produktu "makro", materiału litego [1, 2].
Właściwości nanomateriałów
Zmiany właściwości fizykochemicznych nanomateriałów są często wynikiem ograniczenia kwantowego elektronów w małych nanocząstkach oraz zwiększonego stosunku liczby atomów lub jonów powierzchniowych i przypowierzchniowych do tych znajdujących się wewnątrz danej cząstki. Wynikiem tego jest duża powierzchnia właściwa nanomateriałów, co powoduje zwiększenie się ilości niewysyconych miejsc koordynacyjnych, defektów oraz naprężeń sieci krystalicznej. Stąd też atomy i jony powierzchniowe znajdują się w innym otoczeniu koordynacyjnym, co warunkuje zmianę właściwości fizykochemicznych wielu nanomateriałów. Jako przykłady można podać: zmianę właściwości spektroskopowych, temperatury topnienia, gęstości, rozpuszczalności, właściwości mechanicznych (tarcie, ciągliwość, sprężystość), przewodnictwa elektrycznego, napięcia powierzchniowego, inna odpowiedź na przyłożone pole magnetyczne, zmiany w strukturze krystalicznej (pewne struktury są stabilne jedynie w skali nanometrycznej) czy podwyższoną aktywnością katalityczną nanomateriałów [1, 3÷7].
Ograniczenie kwantowe
Efektem występującym w skali "nano" może być ograniczenie kwantowe (ang.quantum confinement) występujące najczęściej w półprzewodnikach, przeważnie gdy wielkość cząstek jest mniejsza od 10 nm, a dokładniej rozmiar ten zależy od wielkości promienia Bohra ekscytonu w danym materiale [8, 9]. Nanostruktury półprzewodnikowe, w których występuje to zjawisko, ograniczone w jednym wymiarze zwane są studniami kwantowymi (ang.quantum wells) [10], ograniczone w dwóch wymiarach, to tzw. druty kwantowe (ang.quantum wires) [11], a w trzech, to kropki kwantowe (ang.quantum dots) [12, 13].
Spektakularnym efektem wspomnianego zjawiska jest wielokolorowa luminescencja kropek kwantowych. Pod wpływem naświetlenia promieniowaniem UV o określonej długości fali, następuje emisja w zakresie widzialnym, zależnym od wielkości nanocząstek tworzących dany produkt. W pierwszym przybliżeniu można to wyjaśnić zwiększaniem się przerwy wzbronionej, tj. odległości pomiędzy orbitalami HOMOLUMO (ang.Highest Occupied Molecular Orbital - Lowest UnoccupiedMolecular Orbital), wraz ze zmniejszaniem się rozmiaru cząstek. Oznacza to, iż mniejsze nanocząstki danego półprzewodnika, np. CdSe, CdS czy ZnO będą wykazywać pod wpływem promieniowania UV luminescencję przesuniętą w stronę barwy niebieskiej, a większe w stronę barwy czerwonej [14, 15].
Plazmony powierzchniowe
Kolejnym przykładem zjawisk obserwowanych tylko w nanomateriałach, jest zmiana barwy nanostrukturalnych cząstek metali, np. złota, które to wraz ze zmniejszeniem się ich rozmiaru zmieniają kolor, poczynając od niebieskiego (większe cząstki) a na czerwonym kończąc (mniejsze cząstki). Spowodowane jest to rezonansową absorpcją promieniowania przez oscylujące, powierzchniowe elektrony walencyjne, tzw. plazmony powierzchniowe (ang.surface plasmons) w nanocząstkach metalicznych. Wynikiem tego zjawiska jest różnicowa absorpcja światła widzialnego, zależna od wielkości nanocząstek. Efekt ten pojawia się przeważnie, gdy ich rozmiar jest mniejszy od 150 nm (jednak zanika w przypadku zbyt małych cząstek) i jest silnie zależny od morfologii produktu [16, 17].
Superparamagnetyzm
W przypadku właściwości magnetycznych nanocząstek, zmianą następującą w skali "nano" jest zjawisko superparamagnetyzmu. Superparamagnetyzm występuje w ferro- i ferrimagnetykach po zmniejszeniu rozmiaru ich cząstek do skali "nano" (przeważnie od kilku do kilkudziesięciu nanometrów). Krytyczny rozmiar warunkujący pojawienie się omawianego zjawiska zależy od rodzaju materiału, a dokładniej wartości jego anizotropii magnetycznej zależnej od składu chemicznego, struktury krystalicznej i morfologii. W materiałach superparamagnetycznych nie występuje zjawisko remanencji (pomagnetyzacji jaka pozostaje po odjęciu zewnętrznego pola magnetycznego), a koercja (wartość pola magnetycznego potrzebna do zredukowania do zera pozostałej magnetyzacji materiału) jest równa zeru. Powoduje to powstanie tzw. granicy superparamagnetycznej. Jest to krytyczny rozmiar cząstek, który wyznacza maksymalną pojemność nośników danych opartych na pamięciach magnetycznych. Znanym przykładem są nanocząstki magnetytu - Fe3O4, które stają się superparamagnetyczne po osiągnięciu rozmiarów mniejszych niż ≈ 12 nm. Gdy pole magnetyczne zostanie wyłączone, takie nanocząstki tracą magnetyzację z powodu uśrednienia się momentów magnetycznych pojedynczych krystalitów (każde ziarno składa się tu z jednej domeny magnetycznej) spowodowanego energią cieplną [18, 19].
Toksyczność nanocząstek
Obecnie bardzo ważnym problemem jest kwestia toksyczności nanocząstek.
Jak już wspomniano, nanomateriały charakteryzują się często odmiennymi właściwościami w porównaniu do ich odpowiedników w skali "makroskopowej", co wpływa również na ich właściwości biologiczne.
Niestety, ta zmiana jest często niekorzystna w przypadku zastosowań biologicznych, z powodu występowania efektu cytotoksyczności małych nanocząstek. Często materiały normalnie obojętne dla organizmów żywych, wykazują znaczny wzrost cytotoksyczności, gdy zmniejszy się rozmiar tworzących je cząstek do skali nanometrycznej [20, 21]. Toksyczność ta może być spowodowana łatwiejszym, zwięk szonym uwalnianiem się jonów metali ciężkich z powierzchni nanocząstek, jak w przypadku kropek kwantowych, takich jak CdSe, CdTe czy PbS [22, 23]. Cytotoksyczność nanomateriałów może być również spowodowana porowatością nanocząstek, tendencją do aglomeracji, znacznym powinowactwem chemicznym do wielu struktur biologicznych czy zwiększoną reaktywnością chemiczną ich powierzchni [24, 25]. Ważną rolę odgrywają również czynniki fizyczne i mechaniczne, takie jak rozmiar porównywalny lub mniejszy od struktur biologicznych.
Poprzez tworzenie stabilnych zawiesin w powietrzu, materiały te tworzą szkodliwe pyły, które inhalowane przez człowieka, mogą powodować pylicę oraz raka płuc [26, 27]. Nanocząstki ze względu na ich niewielki rozmiar mogą zostać wchłonięte na skutek endocytozy przez niektóre komórki organizmów żywych oraz kumulować się na skutek przyłączania się do białek, błon komórkowych i innych struktur biologicznych [25]. Wspomniane procesy mogą powodować uszkodzenia komórek i tkanek poprzez zwiększony stres oksydacyjny, blokowanie kanałów jonowych, czy mechaniczne uszkodzenie błony komórkowej i innych organelli [28, 29]. Czynniki te mogą równie zaburzać proliferację komórek, w wyniku czego następuje ich obumieranie lub niekontrolowany wzrost mogący prowadzić do powstawania zmian nowotworowych [30].
Metody wytwarzania nanostruktur
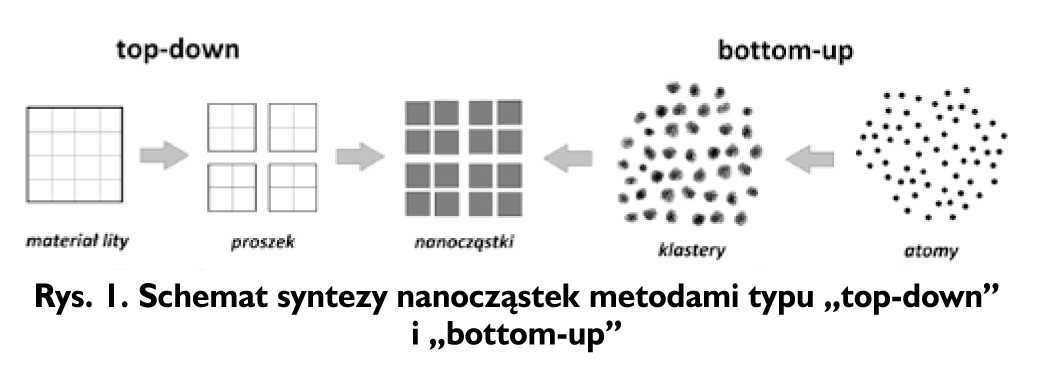
Istnieje wiele metod wytwarzania nanostruktur, które można podzielić na dwa rodzaje, a mianowicie metody typu "top-down" i "bottom- up" [1, 31, 32]. Pierwsza z nich polega na rozdrabnianiu litych materiałów do nanocząstek, czyli ich odpowiedników w skali "nano".
Do metod typu "top-down" możemy zaliczyć kruszenie i mielenie w młynach kulowych, czy różne rodzaje litografii.
Znacznie lepsze rezultaty (mniej defektów oraz węższa dystrybucja wielkości i morfologii ziaren) można uzyskać za pomocą metod typu "bottom-up", polegających na wzroście nanokrystalitów i jego kontrolowanym zaprzestaniu, poprzez tworzenie nanostruktur "atom po atomie". Odbywa się to na drodze samoistnego łączenia się pojedynczych atomów w większe zespoły, tzw. klastery i ich dalszą agregację do nanocząstek. Polegają one na otrzymywaniu nanomateriałów na drodze syntezy chemicznej, jak również dzięki wykorzystaniu odpowiednich procesów fizycznych. Przykładami często stosowanych metod typu "bottom-up" może być: współstrącanie nanoproduktów w roztworach, nanoszenie reagentów warstwa po warstwie (technika Langmuira-Blodgett), rozkład prekursorów organicznych, synteza w warunkach hydrotermalnych, hydroliza reagentów i ich późniejsza kondensacja, powierzchniowa wymiana redox, napylanie w próżni, metody kondensacji w fazie ciekłej lub gazowej itp. Schemat otrzymywania nanocząstek metodami "top-down" i "bottom-up" został przedstawiony na Rysunku 1.
Nanostruktury luminescencyjne
Struktury wykazujące luminescencję były i są nadal intensywnie badane, gdyż znajdują zastosowania w wielu dziedzinach nauki i przemysłu [33]. W przeszłości najbardziej powszechnymi luminoforami były barwniki organiczne z powodu ich dużego molowego współczynnika absorpcji światła ultrafioletowego. Okazały się jednak niestabilne z powodu małej odporności na długotrwałe działanie światła i łatwy rozkład poprzez utlenianie. Barwniki takie po pewnym czasie blakną i świecą coraz słabiej. Dlatego też duże zainteresowanie wzbudziły kropki kwantowe. Nanostruktury o charakterze kropek kwantowych, są odporne na fotodegradację, wysoką temperaturę i wykazują intensywną luminescencję z powodu szerokiego zakresu widmowego, w którym mogą absorbować promieniowanie, skutkujące wzbudzeniem elektronów i ich późniejszą promienistą relaksacją [34]. Jednak ich zasadniczą wadą jest znaczna cytotoksyczność, spowodowana obecnością w ich składzie metali ciężkich [22]. Obiecującą grupą luminoforów, wydają się być rozmaite, nieorganiczne związki chemiczne takie jak tlenki, fluorki, tlenofluorki, borany, fosforany czy wanadany, domieszkowane lub złożone z pierwiastków ziem rzadkich. Takie luminofory są odporne na fotodegradację, wysoką temperaturę, procesy redox, czynniki agresywne czy promieniowanie UV. Charakteryzują się również znacznie niższą od kropek kwantowych toksycznością, dzięki czemu mogą być z powodzeniem stosowane z aplikacjach biologicznych [35, 36÷38].
Wykazują też intensywną, wielokolorową luminescencję, przy czym mają również wąskie pasma emisyjne. Intensywna luminescencja jest spowodowana efektami przeniesienia ładunku (ang.charge transfer) i przeniesienia energii (ang.energy transfer) [39, 40]. Luminofory na bazie pierwiastków ziem rzadkich znajdują zastosowanie w wyświetlaczach plazmowych [33], systemach detekcyjnych [41], biomarkerach [42, 43], optoelektronice [44], oświetleniu [33], znacznikach luminescencyjnych [45], czy w nanostrukturach typu core/shell, gdzie mogą zostać użyte jako rdzenie luminescencyjne [35, 36].
Nanocząstki magnetyczne
W wielu zastosowaniach nanomateriałów kompozytowych ważne jest, aby dany produkt wykazywał pożądane właściwości magnetyczne, do czego wykorzystuje się w głównej mierze ferri- i ferromagnetyki [46]. Sferyczne, hybrydowe nanostruktury typu core/shell posiadające magnetyczny rdzeń, np. Fe3O4/SiO2, mogą być wykorzystane jako związki oczyszczające wodę i inne media zawierające jony metali ciężkich, takich jak Hg2+, Pb2+, Cd2+ [47]. Usunięcie ich staje się możliwe dzięki znacznemu powinowactwu odpowiednio sfunkcjonalizowanej powłoki do wspomnianych jonów. Poprzez manipulowanie polem magnetycznym, nanocząstki o odpowiednio zmodyfikowanej powierzchni mogą wiązać się do błony komórkowej bakterii, wirusów lub przyłączać się do wybranych komórek w organizmie, które zostały chorobowo zmienione [48]. Następnie możliwe staje się usunięcie takich połączeń z organizmu lub selektywne zniszczenie danych komórek. Małe superparamagnetyczne nanocząstki magnetytu są stosowane jako substancje kontrastowe w MRI (ang.Magnetic Resonance Imaging - obrazowanie metodą rezonansu magnetycznego) [49]. Gdy takie nanocząstki zostaną zmodyfikowane, pokryte odpowiednią powłoką, ich właściwości kontrastowe i stabilność mogą zostać dodatkowo zwiększone.
Nanostruktury typu core/shell
Nanocząstki typu core/shell (rdzeń/powłoka) zbudowane są z co najmniej dwóch różnych faz o odmiennym składzie chemicznym lub innej strukturze. Dzięki tej własności, taki materiał hybrydowy staje się wielofunkcyjny, gdyż posiada jednocześnie właściwości zarówno rdzenia jak i powłoki. Na Rysunku 2 został przedstawiony schemat budowy przykładowej nanostruktury typu core/shell.
Centrum danej cząstki stanowi najczęściej nieorganiczny nanordzeń pokryty jedną lub kilkoma powłokami o odmiennej strukturze lub składzie chemicznym. Właściwości rdzenia można modyfikować i, w zależności od późniejszego wykorzystania produktu, może on być magnetyczny, jak magnetyt - Fe3O4 [19, 47], wykazywać właściwości luminescencyjne, jak np. półprzewodnikowe kropki kwantowe, takie jak ZnO, CdSe [50, 51], czy nanokrystaliczne luminofory domieszkowane jonami lantanowców (Ln3+), np. CeF3:Ln3+ , LaPO4:Ln3+ (Ln =Eu, Tb, Sm, Gd) [35, 52÷54], lub wykazywać inne pożądane właściwości.
Powłoka może być zarówno polimerem organicznym [42, 55], jak i związkiem nieorganicznym np. TiO2 czy SiO2 [35, 36, 56].
Metody otrzymywania nanostruktur typu core/shell
Istnieją liczne metody otrzymywania nanostruktur typu core/shell.
Najpowszechniej stosowane są metody polegające na wytrącaniu pożądanego związku o charakterze powłoki na powierzchni rdzenia, wymiana redox (utlenianie/redukcja powierzchni), wytrawianie warstwy powierzchniowej, czy opłaszczanie rdzenia cząsteczkami modyfikatora organicznego w roztworze. Bardzo często stosowane są także techniki typu zol-żel, takie jak metoda Stöbera [57] polegająca na hydrolizie odpowiednich prekursorów powłoki (pochodne silanowe) i ich późniejsza kondensacja na powierzchni rdzenia, który został uprzednio zdyspergowany w roztworze reakcyjnym. Rysunek 3 przedstawia wybrane metody otrzymywania nanostruktur typu core/shell.
Właściwości nanopowłoki i modyfikacja powierzchni
Małe nanocząstki mają duży stosunek powierzchni do objętości, są więc bardzo czułe na procesy redox, zmianę pH, działanie czynników agresywnych czy wpływ środowiska zewnętrznego. Dlatego też, w celu uniknięcia rozkładu danego produktu lub utraty jego specyficznych właściwości fizykochemicznych, należy pokryć go zewnętrzną powłoką ochronną, co skutkuje utworzeniem się wspomnianych nanostruktur typu core/shell [58, 59]. Taka powłoka może być obojętna lub aktywna w stosunku do określonych ugrupowań chemicznych, lub może zostać zmodyfikowana w sposób zależny od planowanych zastosowań.
Często modyfikuje się powłoki poprzez sprzęganie ich z innymi molekułami organicznymi, biologicznie czynnymi, o charakterze linkerów, antygenów i innych specyficznych indywiduów, dla licznych aplikacji biologicznych [42, 60]. Modyfikacja może zachodzić na skutek utworzenia się trwałego wiązania kowalencyjnego (np. -Si-CH2-NH2) [35, 61] lub oddziaływań elektrostatycznych, czy sił Van der Waalsa [62]. Tak sfunkcjonalizowane nanostruktury typu core/shell mogą wykazywać selektywne powinowactwo do pożądanych ugrupowań chemicznych i miejsc aktywnych w komórce, dzięki czemu możliwe jest ich użycie w nowoczesnych terapiach celowanych jako nośniki leków albo biomarkery [63]. Następstwem takiej modyfikacji, oprócz uzyskania pożądanego powinowactwa/aktywności chemicznej, może być zmiana właściwości biologicznych danych nanocząstek, np. zmniejszenie się ich cytotoksyczności [35, 64]. Warto nadmienić, że znane są także nanostruktury typu yolk/shell podobne do struktur typu core/shell, charakteryzujące się jednak tzw. pustym rdzeniem. Efekt taki można uzyskać już w czasie syntezy lub w wyniku odpowiedniej modyfikacji produktu po syntezie. Wspomniane nanostruktury typu yolk/shell mogą znaleźć zastosowanie np. jako nowoczesne, bardzo wydajne i selektywne nośniki leków w terapiach celowanych (lek zamknięty w pustym rdzeniu i uwalniany selektywnie w pożądanym miejscu).
Jak już wspomniano, zaawansowane nanostruktury typu core/shell są nową klasą materiałów kompozytowych o wielu dotychczas nieznanych właściwościach. Korzyści wynikające z ich stosowania wynikają z ich dwu- lub wielofunkcyjności, dzięki czemu łączą w jednym materiale właściwości rdzenia i powłoki. Takie wielofunkcyjne nanocząstki mogą wykazywać jednocześnie interesujące właściwości, takie jak wielobarwna przestrajalna luminescencja i odpowiedź na przyłożone pole magnetyczne. Co więcej, nanomateriały te mogą charakteryzować się znaczną biodostępnością, biokompatybilnością oraz selektywnością łączenia się z pożądanych strukturami. Rysunek 4 przedstawia jednoczesną zieloną emisję oraz odpowiedź na przyłożone pole magnetyczne luminescencyjno-magnetycznych nanocząstek typu core/shell o składzie Fe3O4/CeF3:Gd3+, Tb3+/SiO2. Zdjęcia zostały wykonane w świetle dziennym oraz ultrafioletowym, przed i po przyłożeniu pola magnetycznego.
Na Rysunku 5 przedstawione zostały zdjęcia z transmisyjnej mikroskopii elektronowej (TEM) luminescencyjnych nanostruktur typu core/shell mających powierzchnię zmodyfikowaną grupami aminowymi (ciemne rdzenie i jasne powłoki).
Nanomateriały takie mogą zostać potencjalnie wykorzystane do obrazowania/detekcji pożądanych struktur oraz ich jednoczesnej separacji magnetycznej. Dzięki wspomnianym właściwościom, związki te mają ogromne możliwości aplikacyjne i mogą zostać wykorzystane w wielu dziedzinach nauki i przemysłu, np. w medycynie, biochemii, kryminalistyce, inżynierii materiałów, nanobioinżynierii czy przemyśle wytwarzającym materiały funkcjonalne i materiały codziennego użytku. Przeważnie jednak otrzymuje się je w skali laboratoryjnej, głównie ze względu na wysokie koszty syntezy, długi czas produkcji oraz częste problemy z powtarzalnością i odtwarzalnością danej metody syntezy.
Podsumowanie
Nanotechnologia jest prężnie rozwijającą się dziedziną umożliwiającą otrzymywanie nowych, dotychczas nieznanych nanostrukturalnych materiałów o unikatowych właściwościach i wszechstronnym zastosowaniu. Nanomateriały takie mogą wykazywać zmienione właściwości spektroskopowe, magnetyczne, strukturalne i biologiczne. Co więcej, niektóre nanocząstki, takie jak wielofunkcyjne nanostruktury typu core/shell, mogą wykazywać naraz kilka pożądanych właściwości, np. luminescencję, magnetyzm, obniżoną cytotoksyczność i zwiększoną reaktywność/powinowactwo do pożądanych struktur. Ważnym aspektem rozwoju nanotechnologii jest ciągłe ulepszanie oraz ujednolicanie syntezy nanomateriałów i modyfikacja ich powierzchni. Dzięki temu udaje się otrzymywać materiały o coraz lepszej homogeniczności i monodyspersyjności.
Istotne jest, aby cała procedura otrzymywania nanomateriałów była relatywnie tania i szybka, synteza była łatwo odtwarzalna, jej produkty były stabilne a używane rozpuszczalniki, reagenty jak i produktów syntezy były nisko toksyczne.
Literatura
1. Kelsal R. W., Hamley I. W., Geoghegan M.:Nanotechnologie. PWN Warszawa 2008, 19-29.
2. Henglein A.:Q-Particles: Size Quantization Effects in Colloidal Semiconductors.
Progr. Colloid Polym. Sci. 1987, 73, 1-3.
3. Polizzi S., Battagliarin M., Bettinelli M., Speghini A., Fagherazzi G.:Investigationon Lanthanide-Doped Y2O3Nanopowders Obtained by Wet Chemical Synthesis. J.
Mater. Chem. 2002, 12, 742-747.
4. Batlle X., Labarta A.;Finite-Size Effects in Fine Particles: Magnetic and TransportProperties. J. Phys. D Appl. Phys. 2002, 35, R15-R42.
5. Ostrikov K., Neyts E. C., Meyyappan M.:Plasma Nanoscience: From Nano-Solidsin Plasmas to Nano-Plasmas in Solids. Adv. Phys. 2013, 62, 113-224.
6. Astruc D., Lu F., Aranzaes J. R.:Nanoparticles as Recyclable Catalysts: The Frontierbetween Homogeneous and Heterogeneous Catalysis. Angew. Chem. Int. Ed.
2005, 44, 7852-7872.
7. Liang Y., Li Y., Wang H., Zhou J., Wang J., Regier T., Dai H.:Co3O4 Nanocrystalson Graphene as a Synergistic Catalyst for Oxygen Reduction Reaction. Nat. Mater.
2011, 10, 780-786.
8. Tang Z., Kotov N., Giersig M.:Spontaneous Organization of Single CdTe Nanoparticlesinto Luminescent Nanowires. Science 2002, 297, 237-240.
9. Chander H.:Development of nanophosphors-A Review. Mater. Sci. Eng. R Rep.
2005, 49, 113-155.
10. Yang L., Motohisa J., Takeda J., Tomioka K., Fukui T.:Size-Dependent Photoluminescenceof Hexagonal Nanopillars with Single InGaAs∕GaAs Quantum WellsFabricated by Selective-Area Metal Organic Vapor Phase Epitaxy. Appl. Phys. Lett.
2006, 89, 203110.
11. Yu H., Li J., Loomis R. A., Wang L.-W., Buhro W. E.:Two- versus Three-DimensionalQuantum Confinement in Indium Phosphide Wires and Dots. Nat. Mater.
2003, 2, 517-520.
12. Alivisatos A. P.:Semiconductor Clusters, Nanocrystals, and Quantum Dots. Science 1996, 271, 933-937.
13. Tvrdy K., Kamat P. V.:Substrate Driven Photochemistry of CdSe Quantum DotFilms: Charge Injection and Irreversible Transformations on Oxide Surfaces. J. Phys.
Chem. A. 2009, 113, 3765-3772.
14. Fojtik A.:Quantum State of Small Semiconductor Clusters - “exciton", RadiationChemistry of “Q-State" Particles. Int. J. Radiat. Appl. Instrum. C Radiat. Phys.
Chem. 1986, 28, 463 - 465.
15. Weller H., Schmidt H.M., Koch U., Fojtik A., H. A.:Onset of Light Absoptionas a Function of Size of Extremely Small CdS Particles. Chem.Phys.Letters 1986, 124, 557-560.
16. Link S.; El-Sayed M. A.:Spectral Properties and Relaxation Dynamics of SurfacePlasmon Electronic Oscillations in Gold and Silver Nanodots and Nanorods. J. Phys.
Chem. B 1999, 103, 8410-8426.
17. Barnes W. L., Dereux A., Ebbesen T. W.:Surface Plasmon Subwavelength Optics.
Nature 2003, 424, 824-830.
18. Skumryev V., Stoyanov S., Zhang Y., Hadjipanayis G., Givord D., Nogués J.:Beating the Superparamagnetic Limit with Exchange Bias. Nature 2003, 423, 850-853.
19. Laurent S., Forge D., Port M., Roch A., Robic C., Vander E. L., Muller R. N.:MagneticIron Oxide Nanoparticles: Synthesis, Stabilization, Vectorization, PhysicochemicalCharacterizations, and Biological Applications. Chem. Rev. 2008, 108, 2064-2110.
20. Love S. A., Maurer-Jones M. A., Thompson J. W., Lin Y.-S., Haynes C. L.:AssessingNanoparticle Toxicity. Annu. Rev. Anal. Chem. 2012, 5, 181-205.
21. Park M. V. D. Z., Neigh A. M., Vermeulen J. P., Fonteyne L. J. J., Verharen H. W., Briedé J. J., Loveren H., Jong W. H.:The Effect of Particle Size on the Cytotoxicity,Inflammation, Developmental Toxicity and Genotoxicity of Silver Nanoparticles.Biomaterials 2011, 32, 9810-9817.
22. Gagné F., Maysinger D., André C., Blaise C.:Cytotoxicity of Aged Cadmium-TellurideQuantum Dots to Rainbow Trout Hepatocytes. Nanotoxicology 2008, 2, 113-120.
23. Kirchner C., Liedl T., Kudera S., Pellegrino T., Muńoz J. A., Gaub H. E., Stölzle S., Fertig N., Parak W. J.:Cytotoxicity of Colloidal CdSe and CdSe/ZnS Nanoparticles.
Nano Lett. 2005, 5, 331-338.
24. Shahbazi M.-A., Hamidi M., Mäkilä E. M., Zhang H., Almeida P. V, Kaasalainen M., Salonen J. J., Hirvonen J. T., Santos H.:The Mechanisms of Surface ChemistryEffects of Mesoporous Silicon Nanoparticles on Immunotoxicity and Biocompatibility.
Biomaterials 2013, 34, 7776-7789.
25. Zhao Y., Sun X., Zhang G., Trewyn B. G., Slowing I. I., Lin V. S.-Y.:Interaction ofMesoporous Silica Nanoparticles with Human Red Blood Cell Membranes: Size andSurface Effects. ACS Nano 2011, 5, 1366-1375.
26. Borm P. J. A., Kreyling W.:Toxicological Hazards of Inhaled Nanoparticles-PotentialImplications for Drug Delivery. J. Nanosci. Nanotech. 2004, 4, 521-531.
27. Geiser M., Kreyling W. G.: Deposition and Biokinetics of Inhaled Nanoparticles.Part. Fibre Toxicol. 2010, 7, 2.
28. Fröhlich E.:Cellular Targets and Mechanisms in the Cytotoxic Action of Non- BiodegradableEngineered Nanoparticles. Curr. Drug Metab. 2013, 14, 976-988.
29. Stoccoro A., Karlsson H. L., Coppedè F., Migliore L.:Epigenetic Effects of Nano-Sized Materials. Toxicology 2013, 313, 3-14.
30. Yang X., Liu J., He H., Zhou L., Gong C., Wang X., Yang L., Yuan J., Huang H., He L.: SiO2Nanoparticles Induce Cytotoxicity and Protein Expression Alteration inHaCaT Cells. Part Fibre Toxicol. 2010, 7, 1-12.
31. Shenhar R., Rotello V. M.:Nanoparticles: Scaffolds and Building Blocks. Acc. Chem.
Res. 2003, 36, 549-561.
32. Lu W., Lieber C. M.:Nanoelectronics from the Bottom Up. Nat. Mater. 2007, 6, 841-850.
33. Yadav R. S., Shukla V. K., Mishra P., Pandey S. K., Kumar K., Baranwal V., Kumar M., Pandey A. C.:Enhanced Blue Luminescence in BaMgAl10O17:Eu, Er, NdNanophosphor for PDPs and Mercury Free Fluorescent Lamps. J. Alloy. Compd.
2013, 547, 1-4.
34. Xing Y., Chaudry Q., Shen C., Kong K. Y., Zhau H. E., Chung L. W.; Petros J., O’Regan R. M., Yezhelyev M. V., Simons J. W.:Bioconjugated Quantum Dots for Multiplexedand Quantitative Immunohistochemistry. Nat. Protoc. 2007, 2, 1152-1165.
35. Runowski M., Dąbrowska K., Grzyb T., Miernikiewicz P., Lis S.:Core/shell-TypeNanorods of Tb3+-Doped LaPO4, Modified with Amine Groups, Revealing ReducedCytotoxicity. J. Nanopart. Res. 2013, 15, 2068-2083.
36. Grzyb T., Runowski M., Dąbrowska K., Giersig M., Lis S.:Structural, Spectroscopicand Cytotoxicity Studies of TbF3@CeF3 and TbF3@CeF3@SiO2 Nanocrystals. J.
Nanopart. Res. 2013, 15, 1958-1972.
37. Wang F., Banerjee D., Liu Y., Chen X., Liu X.:Upconversion Nanoparticles inBiological Labeling, Imaging, and Therapy. Analyst 2010, 135, 1839-1854.
38. Chen X., Zhao Z., Jiang M., Que D., Shi S., Zheng N.:Preparation and PhotodynamicTherapy Application of NaYF4:Yb, Tm-NaYF4:Yb, Er MultifunctionalUpconverting Nanoparticles. New J. Chem. 2013, 37, 1782-1788.
technika 770 nr 9/2014 tom 68 39. Wang F., Fan X., Wang M., Zhang Y.:Multicolour PEI/NaGdF4:Ce3+ ,Ln3+Nanocrystals by Single-Wavelength Excitation. Nanotechnology 2007, 18, 25701-25706.
40. Grzyb T., Runowski M., Szczeszak A., Lis S.:Structural, Morphological andSpectroscopic Properties of Eu3+-Doped Rare Earth Fluorides Synthesizedby the Hydrothermalmethod. J. Solid State Chem. 2013, 200, 76-83.
41. Wang G., Peng Q., Li Y.:Lanthanide-Doped Nanocrystals: Synthesis, Optical-MagneticProperties, and Applications. Acc. Chem. Res. 2011, 44, 322-332.
42. Haidar Z. S.:Bio-Inspired/-Functional Colloidal Core-Shell Polymeric-BasedNanoSystems: Technology Promise in Tissue Engineering, Bioimaging and NanoMedicine.Polymers 2010, 2, 323-352.
43. Liu Y., Tu D., Zhu H., Chen X.:Lanthanide-Doped Luminescent Nanoprobes:Controlled Synthesis, Optical Spectroscopy, and Bioapplications. Chem. Soc.
Rev. 2013, 42, 6924-6958.
44. Zhang D., Chen C., Wang F., Zhang D. M.:Optical Gain and UpconversionLuminescence in LaF3: Er, Yb Nanoparticles-Doped Organic-inorganic HybridMaterials Waveguide Amplifier. Appl. Phys. B 2009, 98, 791-795.
45. Kulpinski P., Namyslak M., Grzyb T., Lis S.: Luminescent Cellulose FibersActivated by Eu3+-Doped Nanoparticles. Cellulose 2012, 19, 1271-1278.
46. Jun Y., Choi J., Cheon J.:Heterostructured Magnetic Nanoparticles: TheirVersatility and High Performance Capabilities. ChemComm 2007, 28, 1203-1214.
47. Wang J., Zheng S., Shao Y., Liu J., Xu Z., Zhu D.:Amino-FunctionalizedFe3O4@SiO2 Core-Shell Magnetic Nanomaterial as a Novel Adsorbent for AqueousHeavy Metals Removal. J. Colloid Interface Sci. 2010, 349, 293-299.
48. Xu H., Aguilar Z. P., Yang L., Kuang M., Duan H., Xiong Y., Wei H., Wang A.:Antibody Conjugated Magnetic Iron Oxide Nanoparticles for Cancer CellSeparation in Fresh Whole Blood. Biomaterials 2011, 32, 9758-9765.
49. Billotey C., Wilhelm C., Devaud M., Bacri J. C., Bittoun J., Gazeau F.:CellInternalization of Anionic Maghemite Nanoparticles: Quantitative Effect onMagnetic Resonance Imaging. Magn. Reson. Med. 2003, 49, 646-654.
50. Hsu S., Lin Y. Y., Huang S., Lem K. W., Nguyen D. H., Lee D. S.:Synthesisof Water-Dispersible Zinc Oxide Quantum Dots with AntibacterialActivity and Low Cytotoxicity for Cell Labeling. Nanotechnology 2013, 24, 475102-475112.
51. Tang Y., Han S., Liu H., Chen X., Huang L., Li X., Zhang J.:The Role of SurfaceChemistry in Determining in Vivo Biodistribution and Toxicity of CdSe/ZnSCore-Shell Quantum Dots. Biomaterials 2013, 34, 8741-55.
52. Grzyb T., Runowski M., Szczeszak A., Lis S.:Influence of Matrix on the Luminescentand Structural Properties of Glycerine-Capped, Tb3+-Doped FluorideNanocrystals. J. Phys. Chem. C 2012, 116, 17188−17196.
53. Runowski M., Lis S.:Preparation and Photophysical Properties of LuminescentNanoparticles Based on Lanthanide Doped Fluorides (LaF3:Ce3+,Gd3+, Eu3+), Obtained in the Presence of Different Surfactants. J. Alloy.
Comp. 2014, 597, 63-71.
54. Runowski M., Balabhadra S., Lis S.:Nanosized Complex Fluorides Based onEu3+ Doped Sr2LnF7 (Ln=La, Gd). J. Rare Earths 2014, 32, 242-247.
55. Ramli R. A., Laftah W. A., Hashim S.:Core-shell Polymers: A Review. RSC Adv.
2013, 3, 15543-15565 56. Pang S. C., Kho S. Y., Chin S. F.:Fabrication of Magnetite/Silica/Titania Core-Shell Nanoparticles. J. Nanomater. 2012, 2012, 1-6.
57. Stöber W.:Controlled Growth of Monodisperse Silica Spheres in the MicronSize Range. J. Colloid Interface Sci. 1968, 26, 62-69.
58. Park J.-N., Zhang P., Hu Y.-S., McFarland E.:W. Synthesis and Characterizationof Sintering-Resistant Silica-Encapsulated Fe3O4 Magnetic NanoparticlesActive for Oxidation and Chemical Looping Combustion. Nanotechnology 2010, 21, 225708-225716.
59. Runowski M., Grzyb T., Lis S.,Bifunctional Luminescent and Magnetic Core/shell Type Nanostructures Fe3O4@CeF3:Tb3+/SiO2. J. Rare Earths 2011, 29, 1117-1122.
60. Warren C. W., Chan P. D.:Bio-Applications of Nanoparticles. Springer S, New York, 2009.
61. Mello M. R., Phanon D., Silveira G. Q., Llewellyn P. L., Ronconi C. M.:Amine-Modified MCM-41 Mesoporous Silica for Carbon Dioxide Capture. Microporous Mesoporous Mater. 2011, 143, 174-179.
62. Jal P. K., Patel S., Mishra B. K.:Chemical Modification of Silica Surface by Immobilizationof Functional Groups for Extractive Concentration of Metal Ions.Talanta 2004, 62, 1005-1028.
63. Yang P., Quan Z., Hou Z., Li C., Kang X., Cheng Z., Lin J.:A Magnetic, Luminescentand Mesoporous Core-Shell Structured Composite Material as DrugCarrier. Biomaterials 2009, 30, 4786-4795.
64. Nabeshi H., Yoshikawa T., Arimori A., Yoshida T., Tochigi S., Hirai T., Akase T., Nagano K., Abe Y., Kamada H.: Effect of Surface Properties of Silica Nanoparticleson Their Cytotoxicity and Cellular Distribution in Murine Macrophages.Nanoscale Res. Lett. 2011, 6, 93-98.




















KOMENTARZE (0)
Do artykułu: Nanotechnologia - nanomateriały, nanocząstki i wielofunkcyjne nanostruktury typu rdzeń/powłoka