Wśród najnowszych rodzajów środków bakteriobójczych i grzybobójczych wyróżnia się nanosrebro. Działanie antybakteryjne i antygrzybiczne nanosrebra potwierdzone zostało już w odniesieniu do 650. rodzajów mikroorganizmów [1÷5]. Jest to spowodowane jego oddziaływaniem z grupą tiolową umieszczoną w L-cysteinie, co w efekcie prowadzi do obniżenia aktywności enzymatycznej białek [1, 6]. Preparaty zawierające nanosrebro stosowane są w takich dziedzinach życia, jak higiena, kosmetologia, profilaktyka, konserwacja i pasteryzacja żywności [1, 6, 7].
Wraz z rozwojem nanotechnologii, opracowano wiele sposobów otrzymywania nanomateriałów. Każdą z metod cechuje inna wydajność procesu i towarzyszące mu ograniczenia technologiczne. Parametry otrzymywanych nanocząstek, tj. kształt, średnica lub najdłuższy wymiar, stabilność, konfiguracja czynników stabilizujących układ suspensyjny i obecność ligandów wiążą się ściśle z wyborem metody prowadzącej do ich otrzymania [6].
W pracy przedstawiono sposób otrzymywania srebra nanostrukturalnego (nanosrebra). Jako środek redukujący jony srebra i stabilizujący nanomateriał zastosowano odpowiednio kwas askorbinowy i żelatynę [9].
Kwas askorbinowy posiada właściwości antyutleniające. Odgrywa istotną rolę w funkcjonowaniu ludzkiego organizmu. Wpływa m.in. na wytwarzanie i zachowanie kolagenu, ułatwia gojenie się ran, zapobiega powstawaniu krwotoków oraz zwiększa odporność na zakażenia i choroby. Stosowany jest w przemyśle spożywczym jako dodatek do żywności oraz w farmaceutykach [9].
Żelatyna jest substancją naturalną, której sucha masa (w 98-99%) stanowi mieszaninę białek i peptydów. Do aminokwasów będących jej podstawowymi składnikami budulcowymi należą glicyna, prolina i hydroksyprolina. W żelatynie występują ponadto takie aminokwasy, jak: kwas glutaminowy, alanina, kwas asparginowy, lizyna, seryna, leucyna, walina, fenyloalanina, treonina, izoleucyna, hydroksylizyna, metionina, histydyna i niewielka ilość tyrozyny. Interesującą właściwością żelatyny jest jej miejscowe działanie przeciwkrwotoczne.
Zasada tamowania miejscowych krwotoków polega na niszczeniu powierzchniowych płytek krwi, co początkuje proces koagulacji.
Żelatyna jest także postrzegana jako substancja poprawiająca ogólną kondycję zdrowotną. Badania potwierdziły, że żelatyna działa kojąco na ból stawów kolanowych, a także niweluje ich sztywność. Żelatyna stosowana jest również jako lek, którego działanie zapobiega i leczy hipowolemię i hipotensję. Lek ten znajduje także zastosowanie w zabiegu hemodylucji. W przemyśle spożywczym żelatyna pełni rolę dodatku do żywności oznaczanego symbolem E441. W 1993 r. Amerykańska Agencja ds. Żywności i Leków nadała żelatynie status Substancji Powszechnie Uważanej za Bezpieczną (GRAS) i stwierdzono, że nie ma przeciwskazań do jej dowolnego stosowania, niezależnie od źródła i kraju pochodzenia [9].
Użycie biozgodnych surowców w procesie otrzymywania nanosrebra jest szczególnie ważne ze względu na możliwość zastosowania go w medycynie, stomatologii, farmacji, kosmetologii itp. Ponadto, stosowany reduktor i stabilizator są nietoksyczne i nieszkodliwe dla środowiska naturalnego. Obojętność ekologiczna użytych związków chemicznych lokuje metodę wśród przyjaznych dla środowiska i jednocześnie sprawia, iż wpisuje się ona w zasady zielonej chemii.
Część eksperymentalna
W celu otrzymania nanosrebra zastosowano reakcję chemiczną w środowisku wodnym. Źródłem jonów srebra był azotan srebra (cz.d.a.), a stabilizatorem żelatyna (cz.d.a.). Kwas L(+)-askorbinowy (cz.d.a.) stosowano jako reduktor. Proces prowadzono w reaktorze ciśnieniowym 4525 PARR [10].
Do wodnego roztworu AgNO3 (100 cm3, 0,001 mol/dm3) dodawano wodny roztwór żelatyny (50 cm3). Roztwór ogrzewano w reaktorze do temperatury 110-150oC. Po uzyskaniu zadanej temperatury, za pomocą pompy wprowadzano do reaktora wodny roztwór kwasu askorbinowego (50 cm3). Reakcję redukcji prowadzono w czasie 2-30 min [10]. Parametry procesu zestawiono w Tablicy 1.
Bezbarwny roztwór azotanu srebra, żelatyny i kwasu askorbinowego stał się po reakcji brązowy, co wskazuje na utworzenie nanocząstek srebra. Otrzymane zawiesiny analizowano po ochłodzeniu.
Badania spektrofotometryczne zawiesin nanosrebra wykonano przy użyciu spektrofotometru Rayleigh UV1800. Średni rozmiar i rozkład frakcyjny nanocząstek wyznaczono za pomocą techniki DLS przy użyciu aparatu Malvern Setasizer Nano ZS. Ocenę morfologii otrzymanych nanocząstek przeprowadzono na podstawie zdjęć otrzymanych z mikroskopu sił atomowych AFM firmy Veeco (USA) NanoScope V.
Omówienie wyników
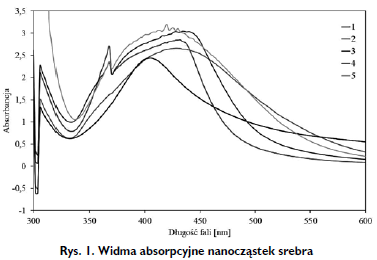
Widma absorpcyjne UV-Vis otrzymanych zawiesin nanosrebra przedstawiono na Rysunku 1. Pik przy 400-450 nm odpowiada charakterystycznemu rezonansowi plazmonów powierzchniowych nanocząsteczek srebra. Plazmony powierzchniowe są zgodnymi oscylacjami elektronów walencyjnych atomów znajdujących się na powierzchni materiału.
Absorpcja promieniowania przez nanocząstki metaliczne zależy od ich wielkości i kształtu. Zespół plazmonowy nie jest symetryczny, co oznacza, że roztwory zawierają zagregowane cząstki. Potwierdzają to mikrofotografie z mikroskopu sił atomowych (Rys. 2). Uzyskane pasma absorpcyjne UV-Vis są szerokie, prawoskośne (z ogonem absorbancji dla dłuższych długości fali), co może wynikać z rozkładów wielkości nanocząstek zaprezentowanych na Rysunku 3. Intensywność rezonansu plazmonowego zależy bowiem od rozmiaru agregatów cząstek i tym samym związek pomiędzy liczbą cząstek i intensywnością absorbancji jest nieliniowy.
Ponadto, gdy cząstki nie są sferyczne i mają kształt zbliżony do elipsoidy, linia absorpcyjna związana z plazmonami powierzchniowymi dzieli się na dwie gałęzie związane z oscylacjami prostopadłymi i równoległymi do długiej osi elipsy. Widać to na widmie absorpcyjnym układu 1, 3 i 5 (Rys. 1).
Na podstawie uzyskanych wyników można wnioskować, że wydłużenie czasu reakcji nie wpływa na proces otrzymywania nanosrebra.
W warunkach prowadzenia procesu nie zaobserwowano również wpływu stężenia kwasu askorbinowego na rozmiar otrzymanych nanocząstek srebra.
W podwyższonej temperaturze żelatyna doskonale rozpuszcza się w wodzie. W środowisku wodnym wiązania pomiędzy poszczególnymi włóknami kolagenowymi pękają, łańcuchy peptydowe ulegają przemieszczeniu tworząc układ koloidalny pozwalający na otrzymanie srebra nanostrukturalnego. Znaczny wzrost temperatury i wynikający z tego wzrost ciśnienia intensyfikują jednak proces grupowania się peptydów w większe aglomeraty, co osłabia stabilizację powstałych nanocząstek srebra i wpływa na ich rozmiar. Wraz ze wzrostem temperatury wzrasta średni rozmiar nanocząstek.
Zwiększenie stężenia żelatyny w roztworze wzmaga stabilizację nanocząstek i umożliwia otrzymanie nanosrebra o mniejszych rozmiarach.
Wnioski
Synteza nanosrebra przeprowadzona została na drodze jednoetapowej redukcji chemicznej. Zastosowane zostały przyjazne dla środowiska związki redukujące oraz stabilizujące. Niewątpliwą zaletą metody jest łatwość prowadzenia procesu i jego kontroli, możliwość regulowania rozmiarów nanocząstek i otrzymania monodyspersyjnych zawiesin.
Praca naukowa finansowana w latach 2010-2013 jako projekt badawczy N N209 411139
Literatura
1. Banach M., Kowalski Z., Wzorek Z.: Nanosrebro - wytwarzanie, właściwości bakteriobójcze, zastosowanie. Chemik 2007, 62, 9, 435-438.
2. Cho K., Park J., Osaka T., Park S.: The study of antimicrobial activity and preservative effects of nanosilver ingredient. Electrochimica Acta 2005, 51, 5, 956-960.
3. Shrivastava S., Bera T., Roy A., Singh G., Ramachandrarao P., Dash D.: Characterization of enhanced antibacterial effects of novel silver nanoparticles.
Nanotechnology 2007, 18, 22, 1-9.
4. Sondi I., Salopek-Sondi B.: Silver nanoparticles as antimicrobial agent: a case study on E. coli as a model for Gram-negative bacteria. Journal of Colloid and Interface Science 2004, 275, 1, 177-182.
5. Wright J.B., Lam K., Hansen D., Burrell R.E.: Efficacy of topical silver against fungal burn wound pathogens. American Journal of Infection Control 1999, 27, 4, 344-350.
6. Pulit J., Banach M., Tymczyna L., Chmielowiec-Korzeniowska A.: Stan badań i kierunki zmian w otrzymywaniu nanostrukturalnego srebra. Przemysł Chemiczny 2012, 91, 5, 929-936.
7. Kowalski Z., Makara A., Banach M.: Zastosowanie preparatów nanosrebra do produkcji hydrolizatu białkowego. Chemik 2009, 62, 11, 425-430.
8. Pulit J., Banach M., Kowalski Z.: Czy wygląd ma znaczenie? Charakterystyka nanosrebra w zależności od kształtu jego cząsteczki. Chemik 2011, 62, 5, 445-456.
9. Zgłoszenie Patentowe P.399112, Polska.
10. Zgłoszenie Patentowe P.399209, Polska.




















KOMENTARZE (0)
Do artykułu: Otrzymywanie nanosrebra na drodze jednoetapowej redukcji chemicznej w środowisku wodnym w warunkach podwyższonego ciśnienia