Zmiany klimatyczne, perspektywa wyczerpywania się zasobów ropy naftowej oraz rosnąca jej cena skłoniły świat do szukania alternatywnych dróg pozyskiwania wartościowych chemikaliów i paliw. W ciągu ostatnich lat rozwijane są technologie, pozwalające na pozyskiwanie kluczowych dla przemysłu chemicznego i motoryzacyjnego produktów, wykorzystujące odnawialne źródło, jakim jest biomasa (ulegająca biodegradacji część produktów, odpadów lub pozostałości z rolnictwa, leśnictwa, a także ulegającą biodegradacji część odpadów przemysłowych i miejskich) [12, 14, 17].
Z chemicznego punktu widzenia, biomasa roślinna składa się z celulozy (30-45%), hemicelulozy (20-35%) i ligniny (10-20%) [1, 12]. Obecnie istotne znaczenie przypisuje się związkom - pochodnym furanów i katalitycznym procesom pozyskiwania ich z cukrów zawartych właśnie w biomasie [12]. Furany w najnowszej Technologicznej Mapie Drogowej Biopaliw dla Transportu (Technology Roadmap, Biofuels for Transport, 2011), opracowanej przez Międzynarodową Agencję Energii, zostały zaliczone do perspektywicznych biopaliw [15]. Związki takie jak furfural, czy 5-hydroksymetylofurfural (HMF) mogą być otrzymywane z dobrą wydajnością poprzez dehydratacje monosacharydów, takich jak heksozy (m.in. fruktoza) albo pentozy (np. ksyloza) w obecności różnych katalizatorów [14].
Furfural
Furfural (FF) stanowi heterocykliczny aldehyd o wzorze sumarycznym C5H4O. Nazwa związku pochodzi od łacińskiej nazwy jednego z surowców, z którego furfural jest otrzymywany (łac. furfur - otręby).
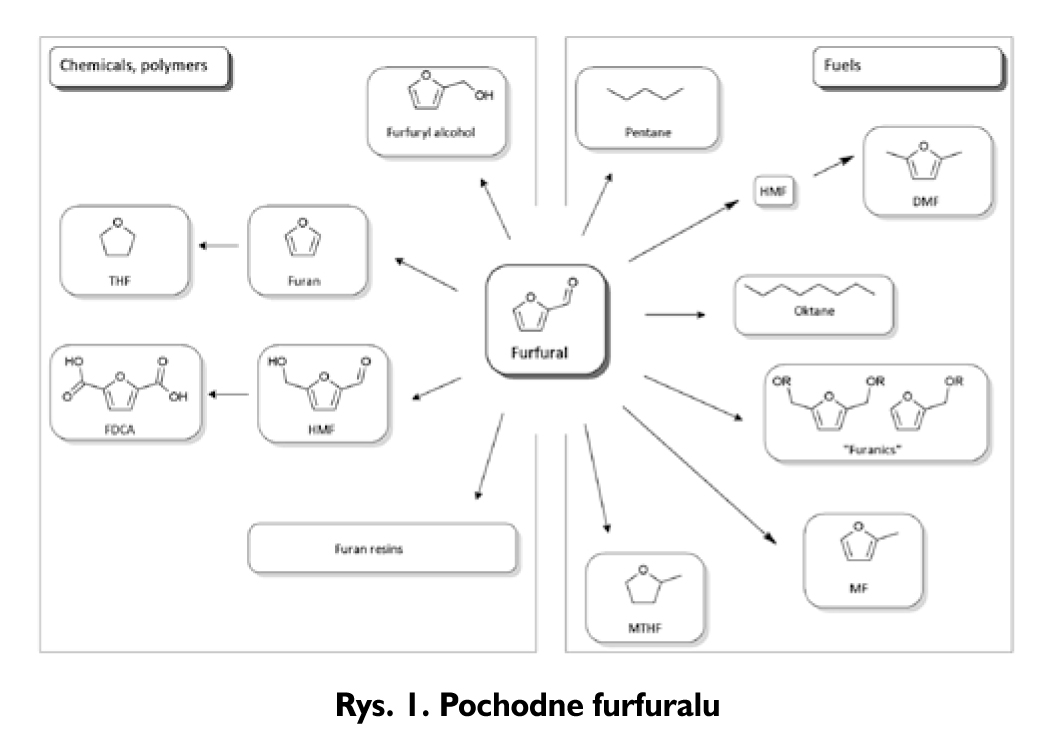
FF w temperaturze pokojowej jest oleistą, bezbarwną cieczą o charakterystycznym, drażniącym, migdałowym zapachu. Pozostawiony na powietrzu w wyniku autooksydacji zmienia barwę na czerwonobrązową [16, 21]. Furfural jest znany od dawna, a jego przemysłową produkcję rozpoczęto w USA już w latach 30. XX w. [1]. Komercyjny proces produkcji furfuralu bazuje na Technologii Quaker Oast. W procesie tym FF jest otrzymywany w katalizowanej kwasami mineralnymi (H2SO4) reakcji dehydratacji ksylozy. Furfural, relatywnie tani aldehyd, jest rozważany jako jeden z ważniejszych półproduktów do syntez wartościowych chemikaliów i biopaliw. Podstawowe ścieżki wykorzystania pochodnych furfuralu przedstawiono na Rysunku 1.
Obecnie w produkcji i konsumpcji furfuralu przodują Chiny (ponad 80% światowej produkcji oraz 72% światowej konsumpcji - dane za rok 2010) [20]. Wyprodukowany furfural w 88% jest używany do otrzymywania alkoholu furfurylowego, który ma wiele ważnych zastosowań przemysłowych. FF używa się również jako rozpuszczalnik w rafinacji olejów smarowych i ekstrakcji butadienów (5% konsumpcji).
Sam furfural nie miesza się z benzynami ani z olejem napędowym i jest mało stabilny chemicznie, lecz jego pochodne, otrzymane na drodze katalitycznej konwersji, mogą znaleźć zastosowanie jako alternatywne biopaliwa i komponenty biopaliwowe [20].
Wybrane pochodne furfuralu, ich synteza i możliwości zastosowania w biopaliwach 2-Metylotetrahydrofuran - komponent paliw serii P
Furfural może być katalitycznie uwodorniony do 2-metylotetrahydrofuranu (2-MTHF), który jest stosowany w innowacyjnych paliwach serii P [7, 12]. Paliwa te, zawierają oprócz 2-metylotetrahydrofuranu: etanol, butan, pentan i wyższe alkany. W zależności od kompozycji, paliwa serii P mogą zawierać od 60 do 100% biokomponentów, przy czym zarówno MTHF, jak i etanol mogą być otrzymywane z lignoceluzlozy pochodzącej z biomasy. 2-MTHF jest komponentem tlenowym o wysokiej zawartości tlenu w swej strukturze (20% m/m), porównywalnej liczbie oktanowej MON do benzyn (ok. 87) i o wyższej wartości opałowej (32 MJ/kg) od etanolu (26,7 MJ/kg).
Alkohol furfurylowy
Z komercyjnego punktu widzenia, najważniejszą do tej pory pochodną furfuralu był alkohol furfurylowy (FA) (C5H6O2). Ten bursztynowy płyn (w 20oC), o słabym zapachu spalenizny stanowi bardzo ważny surowiec dla przemysłu polimerowego [21]. W 2010 r. ponad 85% wyprodukowanego na świecie alkoholu furfurylowego zużyto do produkcji żywic furanowych. Alkohol furfurylowy stosuje się także w rozpuszczalnikach, substancjach poprawiających smak i zapach, pestycydach oraz produktach farmaceutycznych [20]. FA stosuje się również jako paliwo rakietowe: razem z utleniaczem - białym dymiącym kwasem azotowym (WNFA) lub czerwonym dymiącym kwasem azotowym (RNFA), tworzy mieszaninę hipergoliczną (samozapalną) [18].
Alkohol furfurylowy można wytwarzać metodami ciśnieniowymi i bezciśnieniowymi w reakcjach katalitycznego uwodornienia furfuralu [9]. Instalacje działające pod zwiększonym ciśnieniem umożliwiają osiągnięcie stosunkowo dużych wydajności, wymagają jednak stosowania specjalnych, kosztownych rozwiązań w konstrukcji samego reaktora.
Technologie bezciśnieniowe są z powodzeniem stosowane przez firmę Quaker Oats Co. (USA).
W Polsce prowadzono badania nad otrzymywaniem alkoholu furfurylowego z furfuralu w reakcji uwodornienia, zachodzącej w fazie gazowej, pod ciśnieniem atmosferycznym z użyciem katalizatora Cu-Zn z różnymi domieszkami Al, Mn i Fe [9]. Proces prowadzono w temp.
od 150 do 180oC. W celu uwodornienia stosowano zamiennie wodór i mieszaninę wodoru i azotu. Najlepsze rezultaty otrzymano dla katalizatora miedziowo-cynkowego o następującym składzie (w % m/m): CuO - 62,0; ZnO - 21,0; A12O3 - 12,2; MnO2 - 2,2 i Fe2O3 - 0,2.
W przypadku użycia wodoru uzyskano nieznacznie lepsze stopnie konwersji i selektywności, przy czym najwyższy stopień konwersji (ponad 98%) uzyskano w zakresie temp. 160...180oC.
Ostatnio Sitthisa i Resasco opracowali metodę konwersji furfuralu do alkoholu furfurylowego stosując katalizator miedziowy na krzemionce (Cu/SiO2) [13]. Reakcję uwodornienia prowadzono w kwarcowym reaktorze przepływowym, w temperaturze 210...290oC, stosując wodór pod ciśnieniem atmosferycznym. Najlepszą, 71% wydajność otrzymywania tego alkoholu otrzymano w 270oC przy 77% konwersji furfuralu. Jednym ubocznym produktem był 2-metylofuran (2-MF), który dzięki wysokiej liczbie oktanowej badawczej, RON (131), może stanowić komponent poprawiający liczbę oktanową paliw. Co ciekawe, prowadząc reakcję w tych samych warunkach, zmieniając jedynie katalizator na Pd/SiO2, jako główny produkt uwodornienia uzyskano kolejną wartościową pochodną furfuralu - furan. Dalsze uwodornienie furanu prowadzi do otrzymania tetrahydrofuranu (THF), który jest używany jako popularny, komercyjny rozpuszczalnik.
Otrzymywanie ciekłych alkanów z furfuralu
Furfural pozyskiwany z biomasy jest dobrze rokującym surowcem do syntezy alkanów, które stanowią podstawowy składnik paliw.
Grupa badawcza pod kierunkiem Dumesica [6], opracowała metodę otrzymywania z pochodnych furanu ciekłych alkanów zawierających w swej strukturze od 7 do 15 atomów węgla, a więc takich, które mogą stanowić komponent paliwowy [17]. Metoda ta opiera się na trzech procesach: kondensacji aldolowej furfuralu lub HMF z dimetyloketonem (acetonem), lub ewentualnej samo-kondensacji, lub kondensacji produktów przejściowych z substratami, reakcji uwodornienia otrzymanych aldoli do alkoholi i ich dalszej dehydratacji/uwodornieniu prowadzącej do odpowiednich alkanów. Reakcje prowadzono w obecności stałego katalizatora Pt/SiO2-Al2O3 lub Pd/MgO-ZrO2, przy wysokim ciśnieniu i temperaturze (5,2-6 MPa, 250...260oC). Katalizator w tej reakcji ulega zatruciu w wyniku powstawania depozytów węglowych, a w mieszaninie produktów występują również alkany o krótszym łańcuchu niż oczekiwano (możliwa hydrogenoliza wiązań C-C spowodowana wysoką temperaturą i ciśnieniem).
Obecnie poszukuje się sposobów pozwalających na otrzymanie alkanów z furfuralu z dobrą selektywnością, wydajnością i w łagodniejszych warunkach. Nowa metoda spełniająca te wymagania została opisana w pracy [17]. W procesie użyto dwa, nowe dwufunkcyjne katalizatory Pt/Co2AlO4 i Pt/NbOPO4, co pozwoliło na otrzymanie z furfuralu oktanu, z wysoką (76%) wydajnością przy niższych wartościach temperatury i ciśnienia. Idea procesu została przedstawiona na Rysunku 2.
Furfural, w pierwszym etapie procesu, został poddany kondensacji aldolowej z dimetyloketonem w obecności katalizatora: Pt/Co2AlO4 lub NaOH. Otrzymany aldol (4-(2-furylo)-3-buten-2-on) (1) poddany katalitycznemu uwodornieniu utworzył mieszaninę produktów (związki (2), (3), (4) i (5) na Rysunku 2). Powstałe diole przekształcono w oktan w reakcji dehydratacji/uwodornienia stosując jako katalizator Pt/NbOPO4. Udowodniono, że dzięki użyciu wspomnianego katalizatora, także część pierścieniowego 4-(2-tetrahydrofurylo)-butan- 2-olu (3) uległa konwersji do oktanu, co dodatkowo zwiększyło wydajność procesu.
W Chinach opracowano inną metodę pozwalającą na otrzymywanie z furfuralu kolejnego alifatycznego węglowodoru - pentanu [19].
W procesie tym pentan otrzymano w szeregu katalitycznych reakcji uwodornienia i dehydratacji prowadzonych w fazie wodnej (Rys. 3).
Zastosowano dwufunkcyjny katalizator (Ni/SiO2-Al2O3 lub Ni/γ-Al2O3).
Niewątpliwie zaletą syntezy jest to, że przebiega ona w jednym reaktorze i w umiarkowanych warunkach (3MPa, 110...220oC). Otrzymany pentan może być stosowany jako biokomponent do benzyn (gdy jest dodawany bezpośrednio do konwencjonalnej benzyny).
"Furanics" - paliwa przyszłości
W ostatnich latach firma Avantium, doceniając możliwości zastosowania furanów jako wysokowartościowych surowców, opracowała nową metodę (technologia YXY) otrzymywania z nich chemikaliów, polimerów, jak i alternatywnych paliw wyższych generacji. Metoda ta bazuje na katalitycznej konwersji monosacharydów pozyskanych z biomasy (mieszanina pentoz i heksoz) w obecności alkoholu w związki furanowe i ich dalszym przekształceniu w reakcji uwodornienia lub/i eteryfikacji [4, 23]. Idea procesu produkcji paliw w technologii YXY została przedstawiona na Rysunku 4.
W pierwszym etapie syntezy, w obecności kwasowego katalizatora i alkoholu, pentozy ulegają dehydratacji dając furfural. W tym samym etapie, heksozy przekształcane są w etery RMF (alkoksymetylofurfurale).
Jednym ze związków furanowych otrzymywanych w tym etapie jest etoksymetylofurfural (EMF), o temperaturze wrzenia równej 235oC i energii odpowiadającej wartości przeliczeniowej 8,7 kWh/l.
Pod względem energetycznym EMF jest lepszym paliwem od etanolu (6,1 kWh/l), zbliżonym do benzyny (8,8kWh/l) i nieco gorszym niż olej napędowy (9,7 kWh/l) [8]. EMF ze względu na wysoką temperaturę wrzenia jest szczególnie atrakcyjny jako dodatek do olejów napędowych.
O ile etery typu RMF mogą być stosowane, w odpowiednio dobranej proporcji, jako komponenty paliwowe, to otrzymany w tym samym procesie furfural nie miesza się z benzyną ani z olejem napędowym, dlatego konieczne jest dalsze jego przekształcenie. W drugim etapie znajdujący się w mieszaninie furfural, poddany działaniu wodoru wobec kwasowego katalizatora i alkoholu ulega dalszej konwersji do eteru, który z powodzeniem może być stosowany jako biokomponent paliwowy.
W tych warunkach również RMF ulegają katalitycznemu uwodornieniu/ eteryfikacji do dieterów. W zależności od użytego w tym etapie alkoholu, otrzymuje się różne dietery o lepszej mieszalności niż RMF oraz uzyskuje się lepsze wydajności procesu. Przykładowe etery i dietery otrzymywane w kolejnych etapach procesu YXY przedstawiono na Rysunku 5.
Firma Avantium prowadziła badania nad biopaliwami zawierającymi w swoim składzie m.in. EMF i inne pochodne furanowe (do 30% obj.) [8]. W Intertek (Geleen, Holandia) przeprowadzono niezależne testy olejów zawierających różną ilość eterów furanowych (RMF) pochodzących z procesu YXY. Mieszanki badano przy wykorzystaniu Citroëna Berlingo z silnikiem o zapłonie samoczynnym.
Wyniki dla wszystkich biopaliw badanych przez Avantium były obiecujące, a mianowicie przez 90 minut testów nie odnotowano żadnych problemów z pracą silnika, analiza gazów wylotowych wykazała spadek ilości powstającej sadzy o 16% i emisji SO2 o 17% w porównaniu do konwencjonalnego oleju napędowego (Tab. 1).
Zaletą omawianego procesu jest możliwość otrzymywania komponentów furanowych do paliw stosowanych w silnikach samolotów.
Paliwo lotnicze, ze względu na specyficzne warunki pracy i bezpieczeństwo pasażerów, musi spełnić wiele wymagań [22]. Musi ono charakteryzować się odpowiednio dużą wartością opałową, zarówno objętościową jak i masową. W samolotach istotna jest waga i objętość, a zatem paliwo nie może być zbyt ciężkie i zajmować zbyt dużej objętości.
Paliwo lotnicze powinno mieć także niską temperaturę krzepnięcia.
Na każde 100 m wysokości temperatura maleje średnio o 0,65oC, a więc na wysokości rejsowych maszyn pasażerskich (10 000 m) wynosi nawet -50oC. Na Rysunku 6 przedstawiono pierścieniowe etery tetrhydrofuranowe, otrzymywane w procesie YXY posiadające wysoki potencjał dla zastosowań w paliwach lotniczych. Odznaczają się one wysoką gęstością energii, niską temperaturą krzepnięcia (max. -47oC) i temperaturą zapłonu powyżej 38oC [4].
Etery tetrahydrofuranowe otrzymuje się, podobnie jak dietery, w drugim etapie procesu zmieniając jedynie katalizator. Zastosowanie innego katalizatora pozwala na przeprowadzenie reakcji eteryfikacji furfuralu i produktów pochodzących z pierwszego etapu procesu wraz z uwodornieniem ich pierścienia.
Dimetylofuran (DMF) jako paliwo konkurencyjne do bioetanolu
2,5-dimetylofuran (DMF) jest pochodną furanu, o wzorze stechiometrycznym C6H8O i masie molowej 96,13 g/mol [3]. Może on być stosowany jako rozpuszczalnik organiczny, biokomponent paliwowy, jak i jako samodzielne biopaliwo. DMF jest sklasyfikowany jako biopaliwo drugiej generacji z uwagi na to, że w procesie swojej produkcji wymaga surowców bogatych w lignocelulozę, skrobię i inne polisacharydy, których duży udział występuje w biomasie oraz w biomasie odpadowej pochodzenia przemysłowego [3, 5].
Nową metodę otrzymywania 2,5-DMF do celów paliwowych opracował zespół Romana-Leshkova [10, 11]. Przebieg procesu został przedstawiony na Rysunku 7 .
Synteza 2,5 DMF jest prowadzona dwuetapowo w dwufazowym reaktorze. Pierwszym etapem jest dehydratacja D-fruktozy do hydroksymetylofurfuralu HMF (5-(hydroksymetylo)-2-furaldehydu) katalizowana kwasem (R1 na Rysunku 7). Reaktywna faza wodna w dwufazowym reaktorze zawiera kwasowy katalizator i cukier, a faza ekstrakcyjna zawiera częściowo mieszalne rozpuszczalniki (np. butanol), które ciągle ekstrahują HMF z roztworu. Dodatek NaCl do fazy wodnej polepsza ekstrakcję HMF do fazy organicznej, co prowadzi do rosnącej wydajności HMF bez konieczności użycia rozpuszczalników o wysokim punkcie wrzenia. W drugim etapie 5-HMF jest ekstrahowany do fazy organicznej, a następnie jest przekształcany w 2,5-DMF poprzez hydrogenolizę wiązania C-O za pomocą miedziano-rutenowego katalizatora (CuRu/C) (R2 na Rysunku7).
Następnie oddziela się DMF od rozpuszczalnika i produktów pośrednich (S1). Bardziej lotne komponenty (DMF i woda) mogą być oddzielone od rozpuszczalnika i produktów pośrednich. Końcowy strumień może być odzyskany i zawrócony do reaktora hydrogenolizy. Hydrofobowe produkty DMF i 2-metylofuran przy skraplaniu oddzielają się samoistnie od wody. Zależnie od wymagań ostatecznego składu paliwa, proces destylacyjny może być użyty do bardziej precyzyjnej kontroli dystrybucji komponentów, a także do odzyskania frakcji rozpuszczalnika i jej zawrócenia do reaktora dehydratacyjnego. Wykazano, że do odparowania strumienia zawierającego DMF i 1-butanol, prowadzącego do oddzielenia produktu, trzeba dostarczyć trzy razy mniejszej energii niż do odparowania wodnego roztworu etanolu produkowanego poprzez fermentację [3, 10, 11].
Dimetylofuran jest określany jako perspektywiczny zamiennik etanolu, stosowanego obecnie jako biopaliwo. W porównaniu do etanolu, DMF ma znacznie korzystniejsze właściwości fizykochemiczne, z punktu widzenia zastosowania go jako paliwa silnikowego (Tab. 2) [3].
Jak pokazano w Tablicy 2, DMF jako alternatywne paliwo posiada kilka istotnych zalet w porównaniu z etanolem. Rozpuszczalność DMF w wodzie jest bliska zeru, co ułatwia jego przechowywanie.
Jest też całkowicie rozpuszczalny w węglowodorach oraz innych związkach tlenowych, stosowanych w składzie paliw silnikowych.
Objętościowa wartość opałowa DMF (31,5 MJ/l) jest o 40% większa względem etanolu (23,0 MJ/l) i zbliżona do wartości opałowej benzyny (35,0 MJ/l) [2, 10, 12, 14]. Temperatura wrzenia dimetylofuranu jest o ponad 15oC wyższa w porównaniu do etanolu, przez co jest on mniej lotny i bardziej praktyczny w zastosowaniach paliwowych.
Ponadto dimetylofuran jest związkiem stabilnym pod względem chemicznym, co pozwala na jego magazynowanie przez dłuższy czas. DMF posiada również wiele innych zalet: jest nietoksyczny, nie zawiera siarki, fosforu, metali, benzenu ani wielopierścieniowych węglowodorów aromatycznych. DMF charakteryzuje się wysoką odpornością na spalanie stukowe - jego liczba oktanowa (RON) wynosi 119 i jest wyższa niż RON bioetanolu, czy benzyny.
Stosowanie DMF w składzie benzyny silnikowej (jako komponentu poprawiającego liczbę oktanową paliwa) nie wymaga żadnych zmian w konstrukcji silników, układów zasilania ani systemów dystrybucji.
Problem pojawia się dopiero w przypadku stosowania DMF jako samodzielnego paliwa. Przy istniejących, współcześnie eksploatowanych trakcyjnych silnikach spalinowych o zapłonie iskrowym, w których stosuje się benzyny o liczbie oktanowej rzędu 95-98 (E95 lub E98), czysty DMF nie mógłby być stosowany z uwagi na jego zbyt wysoką liczbę oktanową [3, 5].
Podsumowanie
W artykule przedstawiono wybrane pochodne furfuralu, które mogą stanowić przyszłościowe biokomponenty albo nawet samodzielne biopaliwa. W większości omawianych przykładów opracowywane procesy katalitycznej konwersji pochodzącego z biomasy furfuralu znajdują się dopiero w stadium badań i rozwoju, a zespoły badawcze przeprowadzają pierwsze testy silnikowe nowych mieszanek. Jednak powszechna dostępność biomasy (zwłaszcza tej odpadowej, nie-żywnościowej), chęć zmniejszenia zależności od surowców ropopochodnych i troska o środowisko naturalne, będzie z pewnością stanowić siłę napędową rozwoju technologii wykorzystujących pochodne furfuralu, które nie bez powodu nazywane są "śpiącymi gigantami" (z ang. sleeping giants). Można przypuszczać, iż duże zainteresowanie związkami furanowymi przyczyni się do rozwoju kolejnych katalitycznych procesów konwersji furfuralu i jego pochodnych, co w przyszłości przełoży się na obniżenie kosztów ich otrzymywania. A to z kolei pozwoli na powiększenie skali produkcji, co zaowocuje wprowadzeniem na rynek korzystnych eksploatacyjnie paliw alternatywnych do silników o zapłonie iskrowym, stanowiących perspektywiczny zamiennik dla konwencjonalnych benzyn silnikowych.
Artykuł finansowany z budżetu Zadania Badawczego nr 4 pt. "Opracowanie zintegrowanych technologii wytwarzania paliw i energii z biomasy, odpadów rolniczych i innych" w ramach strategicznego programu badań naukowych i prac rozwojowych pt.: "Zaawansowane technologie pozyskiwania energii" realizowanego ze środków NCBiR i ENERGA SA.
Literatura
1. Burczyk B.: Biorafinerie: ile w nich chemii? Wiadomości Chemiczne Wydawnictwo Uniwersytetu Wrocławskiego 2009, 63, 9-10.
2. Daniel R., Tian G., Xu H., Wyszynski M.L., Wua X., Huang Z.: Effect of spark timing and load on a DISI engine fuelled with 2,5-dimethylfuran. Fuel, Elsevier, 2011, 90, 449-558.
3. Dziołak P.L.: Analiza możliwości zastosowania 2,5-dimetylofuranu jako biopaliwa drugiej generacji. Praca magisterska, Uniwersytet Kardynała Stefana Wyszyńskiego w Warszawie, 2008.
4. Gruter GJ, de Jong E.: Furanics: novel biofuel options from carbohydrates. Biofuels Technology 2009, 1.
5. Głąb J., Górski W.: DMF - nowa koncepcja paliwa silnikowego z polisacharydów. Konferencja "Perspektywy Biopaliw Silnikowych II Generacji w Polsce Polbiof 2007", Kraków, 24-25.10.2007.
6. Huber G.W., Chheda J.N., Barrett Ch.J., Dumesic J.A.: Production of liquid alkanes by aqueous-phase processing of biomassderived carbohydrates. Science 2005, 308, 1446-50.
7. IEA Bioenergy: Gaps in the Research of 2nd Generation Transportation Biofuels, Final report of Task 41, Project 2, 2008.
technika 986 nr 9/2012 tom 66 8. Imhof P., Dias A.S., de Jong E. Gruter G.J.: Furanics: Versalite Molecules for Biofuels and Bulk Chemicals Applications, NAM Abstract, 2009.
9. Nowicki J., Maciejewski Z.: Uwodornienie furfuralu na katalizatorze Cu-Zn pod ciśnieniem atmosferycznym. Przemysł Chemiczny, WNT, 1997, 2, 76.
10. Roman-Leshkov Y., Barrett C.J., Liu Z.Y., Dumesic J.A.: Production of dimethylfuran for liquid fuels from biomass-derived carbohydrates. Nature 2007, 447, 982-5.
11. Roman-Leshkov Y., Barrett C.J., Liu Z.Y., Dumesic J.A.: Production of dimethylfuran for liquid fuels from biomass-derived carbohydrates, Supplementary Information, doi: 10.1038/nature05923, 2007.
12. Shittu A.A.: Catalytic conversion of hemicellulosic sugars into furfural in ionic liquid media. PhD Thesis, The University of Toledo, 2010.
13. Sitthisa S., Resasco D.E.: Hydrodeoxygenation of Furfural Over Supported Metal Catalysts: A Comparative Study of Cu, Pd and Ni. Catalysis Letters, Springer, 2011, 6, 141.
14. Tong X., Ma Y., Li Y.: Biomass into chemicals: Conversion of sugar to furan derivatives by catalytic processes. Applied Catalysis A: General, Elsevier 2010, 385.
15. Technology Roadmap, Biofuels for Transport, OECD/IEA, Paryż 2011.
16. Win D.T: Furfural - Gold from Garbage. AU Journal of Technology 2005, 8, 4.
17. Xu W., Xia Q., Zhang Y., Guo Y., Wang Y., Lu G.: Effective Production of Octane from Biomass Derivatives under Mild Conditions. ChemSusChem, Wiley-VCH, 2011, 4, 12, 1758-1761.
18. Zeitsch K.J.: The Chemistry and Technology of Furfural and its Many By- Products. Elsevier, 2000.
19. Zhang X., Wang T., Ma L., Wu Ch.: Aqueous-phase catalytic process for production of pentane from furfural over nickel-based catalysts. Fuel, Elsevier 2010, 89, 2697-2702.
20. http://www.ihs.com/products/chemical/planning/ceh/furfural.aspx.
21. http://www.dalinyebo.co.za/furfural.
22. Wolveridge P.E.: Aviation Turbine Fuels. In: Modern Petroleum Technology. New York 2001.
23. http://avantium.com/yxy/YXY-technology/YXY-process-technology.html.




















KOMENTARZE (0)
Do artykułu: Katalityczna konwersja furfuralu do biokomponentów paliwowych