Bioczujniki (biosensory) są to urządzenia analityczne do wykrywania lub oznaczania ilościowego substancji w badanym materiale, w obecności wielu innych składników. Składają się one z czułego elementu biologicznego i przetwornika.
Rozwój biosensorów rozpoczyna się od 1962 r. wraz z wynalezieniem przez Lelanda C. Clarka elektrod enzymatycznych. Od tego czasu opracowano bardziej zaawansowane, czulsze i coraz bardziej niezawodne bioczujniki. Znalazły one zastosowanie m.in. w badaniach środowiska [1] , analityce medycznej [2-4] oraz kontroli procesów technologicznych [5].
Definicja i budowa biosensora
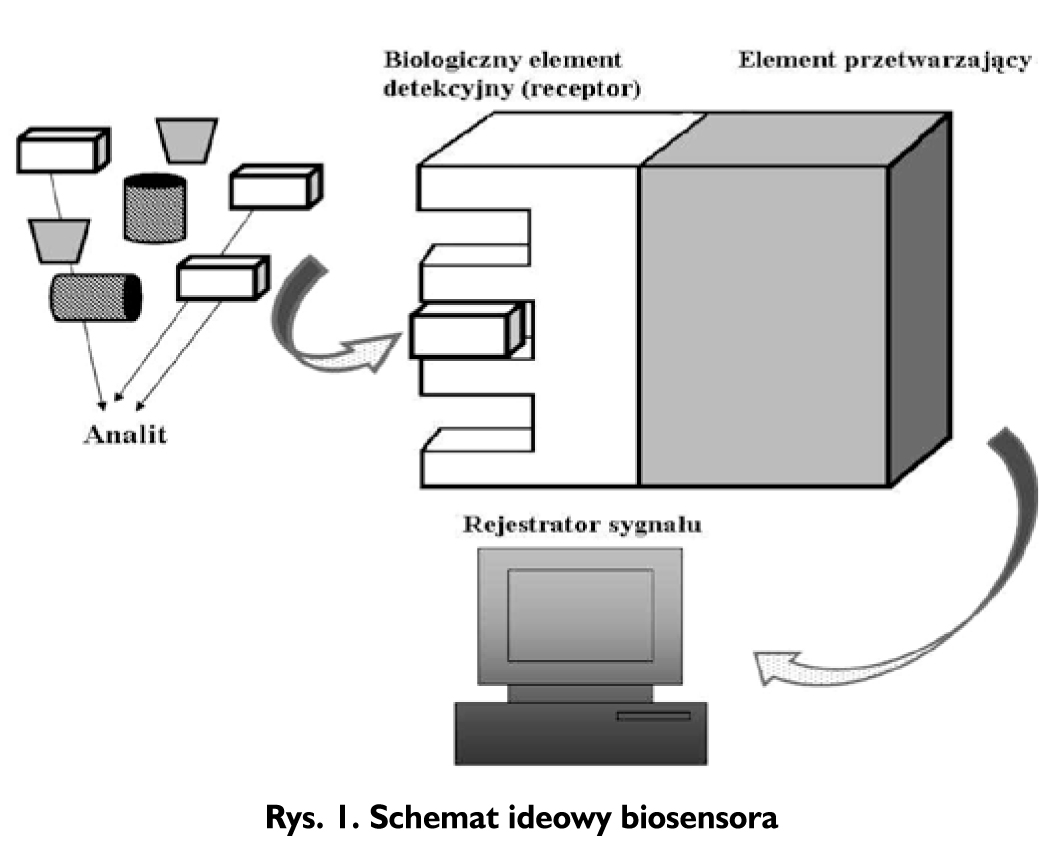
W zależności od obszaru zastosowania, używa się różnych definicji i terminologii biosensora. Mogą być one nazywane immuno-sensorami, bioczipami albo biokomputerami. Według definicji rekomendowanej przez IUPAC (International Union of Pure and Applied Chemistry) jest to urządzenie, w którym do wykrycia związków chemicznych stosuje się określone reakcje biochemiczne w układach zawierających wyizolowane enzymy, systemy immunologiczne, tkanki, organelle albo całe komórki. Składa się on z biologicznie aktywnej części receptorowej oraz elementu przetwornikowego. Zadaniem bio-receptora jest specyficzne oddziaływanie z analitem i jego wychwycenie spośród innych substancji. Przetwornik zamienia biochemiczny sygnał rozpoznania międzycząsteczkowego na sygnał analitycznie użyteczny. Zazwyczaj detekcja polega na pomiarze sygnałów elektrycznych, termicznych lub optycznych [6]. Na Rysunku 1 przedstawiono schemat ideowy biosensora.
O użyteczności biosensora decydują odpowiednie parametry analityczne. Według protokołów walidacyjnych określa się cztery zestawy parametrów: (1) zakres dynamiczny i linowy krzywej kali -bracyjnej, czułość, granica wykrywalności i oznaczalności, (2) selek tywność i wiarygodność otrzymywanych wyników, (3) czas odpowiedzi, (4) powtarzalność, stabilność i „czas życia" biosensora [6].
Podział biosensorów
Biosensory są najczęściej klasyfikowane ze względu na metodę przetwarzania sygnału biologicznego albo zastosowany biologiczny element wykrywający. Podziału można też dokonać ze względu na rodzaj wykrywanej substancji. Jako biologiczny element biosensora stosuje się enzymy [7], przeciwciała [8], inhibitory [9] aptamery [10], żywe organizmy oraz tkanki roślinne lub zwierzęce [11]. Ze względu na rodzaj przekazywania sygnału, biosensory dzieli się na elektrochemiczne [4], akustyczne [12], termiczno/kalorymetryczne [13, 14] oraz optyczne [15] (Rys. 2)
Optyczne biosensory
W ciągu ostatnich kilku dekad obserwowany jest intensywny rozwój zastosowania optycznych biosensorów do badań oddziaływań biomolekuł. Stanowią one potężną alternatywę w stosunku do konwencjonalnych technik analitycznych, zwłaszcza ze względu na wysoką czułość, mały rozmiar, dobre analityczne parametry oraz opłacalność. Tego typu biosensory oparte są na pomiarze zmian parametrów optycznych na skutek reakcji części receptorowej z ana-litem. Generalnie, istnieją dwie możliwości wykrywania substancji: metoda bezznacznikowa (label-free) oraz detekcja oparta na stosowaniu znaczników, np. fluorescencyjnych. Zasadnicza różnica między tymi technikami jest taka, że metoda bez-znacznikowa pozwala na bezpośrednią ocenę właściwości substancji, natomiast przy stosowaniu znaczników obserwuje się efekt fluorescencyjny znakowanej substancji w porównaniu do środowiska.
Optyczne przetworniki mogą być oparte na pomiarach zmian absorbancji, luminescencji, polaryzacji albo współczynnika załamania [16, 17].
Wiele optycznych biosensorów opiera się na zjawisku powierzchniowego rezonansu plazmonów (SPR) w wersji klasycznej oraz różnych modyfikacjach. Jest m.in. powierzchniowy rezonans plazmonów w wersji imaging (SPRI) [18-20], wieloparametrowy powierzchniowy rezonans plazmonów (MP-SPR) [21], zlokalizowany powierzchniowy rezonans plazmonów (L-SPR) [22].
Istota metody SPR
Metoda powierzchniowego rezonansu plazmonów SPR (ang. Surface Plasmon Resonance) jest techniką optyczną badającą zmiany współczynnika załamania spowodowane związaniem się cząsteczek na powierzchni metalu.
W sieci krystalicznej metalu występuje gaz elektronowy, czyli swobodne elektrony-plazmony, które krążą między węzłami sieci krystalicznej. Można przyjąć, że plazmony są odpowiednikiem fotonów, będących kwantami promieniowania elektromagnetycznego. Odgrywają istotną rolę w zjawiskach optycznych zachodzących w warstwie metalu.
Aby doszło do rezonansu plazmonów, energia fotonu padającego na powierzchnię metalu musi być równa energii drgań oscylacyjnych plazmonów. Ze względu na to, że energia plazmonów z wnętrza metalu jest znacznie większa niż fotonów z zakresu światła widzialnego, w rezonans mogą wejść tylko plazmony z powierzchniowej warstwy metalu o grubości 300-400 nm. Dlatego mówimy o zjawisku powierzchniowego rezonansu plazmonów (SPR, ang. Surface Plasmon Resonance).
Efekt SPR można zaobserwować w ściśle określonych warunkach. Przede wszystkim konieczne jest umieszczenie cienkiej warstewki metalicznej między dwoma ośrodkami różniącymi się w sposób istotny gęstością optyczną, np. szkło/woda, szkło/powietrze itp. [23]. Niezbędne jest również wygenerowanie pola nadkrytycznego, które ma postać funkcji wykładniczej zanikającej na powierzchni metalu. Najbardziej odpowiednie metale, to złoto, srebro, platyna, miedź lub glin. Stosowane jest najczęściej złoto, ponieważ charakteryzuje się wysoką stabilnością chemiczną [24].
Do opisu zjawiska powierzchniowego rezonansu plazmonów najbardziej popularne są dwie konfiguracje: Otto i Kretschmanna. W praktyce najczęściej stosuje się konfigurację Kretschmanna. Opiera się ona na zjawisku całkowitego odbicia, które ma miejsce, gdy monochromatyczna, p-spolaryzowana wiązka światła przechodzi przez układ: szkło (o wysokim współczynniku załamania n^/warstwa metalu/dielektryk (o małym współczynniku załamania n2). Pod pewnym kątem wzbudzenia rezonansowego plazmonów następuje zmniejszenie intensywności odbitego światła. Mówimy wówczas o kącie SPR. Jest on bardzo czuły na zmiany powierzchni złota. Technika SPR polega na pomiarze intensywności światła odbitego. Położenie kąta SPR zależy od współczynnika załamania w ośrodku o niższym n przy powierzchni metalu. Zmienia się on na skutek wiązania cząsteczek na powierzchni metalu. Istnieje liniowa zależność między ilością związanych cząsteczek a przesunięciem kąta SPR [24].
Metoda powierzchniowego rezonansu plazmonów w wersji imaging (SPRI)
Tradycyjne sensory SPR mierzą zależność reflektancji jako funkcję kąta padania. Metoda SPRI eliminuje złożoność skanowania kąta, gdyż pomiary dokonywane są przy określonym kącie padania i zbierają światło odbite za pomocą kamery CCD, która odczytuje natężenie światła odbitego w postaci obrazu [25].
Kąt, przy którym prowadzi się pomiary, zawiera się w liniowym obszarze spadku reflektancji, tak żeby zmiany natężenia światła były proporcjonalne do zmian współczynnika załamania światła wywołanych związaniem kolejnych biomolekuł na powierzchni biosensora.
Po adsorpcji kolejnych cząsteczek, rezonans zachodzi przy większych kątach padania. Ilustruje to krzywa I (Rys. 3). Więcej światła ulega odbiciu od miejsc reakcji niż od obszarów pokrytych złotem. Przesunięcie krzywej SPR występuje po interakcji cząsteczek analitu z miejscami reakcyjnymi, co zwiększa stopień odbicia - (krzywa II Rys. 3). W Tablicy 2 przedstawiono różnice klasycznej metody SPR oraz w wersji imaging.
Generalnie, aparatura SPRI składa się z części optycznej, przetwornika, który współdziała z elementami optycznymi, i częścią biochemiczną czujnika oraz układu elektronicznego umożliwiającego przetwarzanie i rejestrację danych. Część optyczna aparatury SPRI zawiera źródło promieniowania (laser He-Ne, argonowy lub dioda LED), elementy optyczne (soczewki, polaryzatory, lustro) oraz pryzmat z cienką warstwą metalu, w którym wzbudzana jest fala rezonansowa plazmonów [26, 27]. Przetwornik przekształca zmiany zachodzące na powierzchni metalu na zmiany współczynnika załamania światła, który może być określany przez optyczną detekcję SPR. W procesie tym sygnał elektryczny jest generowany i przetwarzany przez układ elektroniczny. Aparatura SPRI zwykle wyposażona jest w kamerę CCD do wychwytywania światła odbitego z całej powierzchni czipa. Bardzo ważną częścią układu SPRI jest czujnik z czułym elementem rozpoznającym. Konstrukcja powierzchni takiego czujnika zależy od jego producenta i praktycznego zastosowania. Zazwyczaj jest to czip szklany z warstwą obojętnego metalu (złota o grubości 50 nm). Niemodyfikowana warstwa złota nie jest odpowiednim środowiskiem dla biomolekularnych interakcji, w związku z tym, warstwy złota są modyfikowane, np. monowarstwą tiolu [24]. Unieruchomienie biokomponentów na zmodyfikowanej chemicznie warstwie ztota jest zwykle wykonywane za pomocą: adsorpcji, wiązań kowalencyjnych, oddziatywań hydrofobowych lub specyficznego powinowactwa cząstek [28]. Jest to ważny etap w procesie tworzenia czujnika biologicznego, ponieważ wptywa na jego wydajność.
Zastosowanie biosensorów SPRI
Komercyjny aparat do pomiarów SPR pojawit się w 1990 r. i stat się kluczowym narzędziem badawczym dla rozwoju nauk farmaceutycznych, kontroli jakości żywności, monitoringu środowiska oraz analiz klinicznych [29]. W ciągu ostatnich lat opublikowano wiele prac dotyczących praktycznego zastosowania techniki SPR jako metody detekcji. Jednak jednym z najbardziej istotnych osiągnięć w tej dziedzinie jest SPR w wersji imaging (SPRI), który stanowi obiecującą i uniwersalną metodę detekcji w postaci tablicy z wieloma aktywnymi miejscami (spotami). Każde z nich może dostarczać informacji o efekcie SPR jednocześnie. Biosensory SPRI można stosować do badania interakcji w różnych uktadach biologicznych zawierających biatka, oligonukleotydy, oligosacharydy, lipidy, fagi, cząstki oraz komórki wirusów. Przyktady praktycznych zastosowań biosensorów SPRI przedstawiono w Tablicy 2.
Podsumowanie
Technika SPRI umożliwia monitorowanie oddziatywań w czasie rzeczywistym i jest tzw. metodą label-free. Nie wymaga użycia znaczników, jak np. w metodach fluorescencyjnych czy nawet w testach ELISA. To powoduje, że oznaczane substancje nie tracą swoich wtaściwości funkcjonalnych. Biosensory z detekcją SPRI reprezentują metodę do oznaczania wielu (nawet do stu) interakcji biologicznych jednocześnie, co daje możliwość wielosktadnikowej analizy w próbkach. Rozwój metod z wykorzystaniem tej techniki otwiera drogę do oznaczania biomolekut w próbkach rzeczywistych na szeroką skalę. Potączenie biosensorów z techniką SPRI jest szansą na szybką, tanią i nie uciążliwą diagnostykę pacjentów oraz analizę różnych próbek środowiskowych.
Literatura
1. Rodriguez-Mozaz S., López de Alda M. J., Marco M.P, Barcelo D.: Biosensors for environmentalmonitoring. Aglobalperspective., Talantav 2005, 65, 291-297.
2. Gorodkiewicz E., Regulska E., Roszkowska -Jakimiec W:. Determination of the active form concentration of cathepsin D and B by SPRI biosensor. Journal of Labo-ratory diagnostics 2010, 46, 107-109.
3. Tothill I.E,: Biosensors for cancer markers diagnosis. Semin. Cell. Dev. Biol. 2009, 20, 55-62.
4. Monośik R., Stred'ansty M., Sturdik E,: Application of Electrochemical Biosensors in Clinical Diagnosi., J. Clin. Lab. Anal. 2012, 26(1), 22-34.
5. Katrlik J., Mastihuba V, Vostiar I., Sefćovićova J., Stefuca V, Gemeinar P: Ampe-rometric biosensors based on two different enzyme systems and their use for glycerol determination in samples from biotechnological fermentation process. Anal. Chim. Acta 2006, 566, 11-18.
6. Thevenot D.R., Toth K., Durst RA, Wilson G.S.: Electrochemical Biosensors: Recommended Definition and Classification. Pure. Appl. Chem. 1999, 7, 2333-2348.
7. Gorodkiewicz E., Łuszczyn J.: Surface Plasmon Resonance Imaging (SPRI) Sensor for Cystatin Determination Based on Immobilized Papain, 2011. Prot. Pept. Lett., 18, 23-29.
8. Shabani A. , Tabrizian M.: Design of a universal biointerface for sensitive, selective, and multiplex detection of biomarkers using surface plasmon resonance imaging. Analyst 2013, 138, 6052-6062.
9. Gorodkiewicz E., Ostrowska H., Sankiewicz A.: SPR imaging biosensor for the 20S proteasome; sensor development and application to measurement ofproteaso-mes in human bloodplasma.. Microchim. Acta 2011, 175, 177-184.
10. Daniel C. MelaTne F, Livache T, Buhot A.: Real time monitoring of thrombin inte-ractions with its aptamers: insights into the sandwich complex formation. Biosens. Bioelectron. 2013, 40(1), 186-192.
11. Vo-Dinh T, Cullum B.: Biosensors and biochips: Advances in biological andmedical diagnostics. Fresenius J. Anal. Chem. 2000, 366, 540-551.
12. Janshoff A., Galla H.J., Steinem C.: Piezoelectricmass-sensingdevicesasbiosensor-s-An alternative to optical biosensors? Angew. Chem. Int. 2000, 39,4004-4032.
13. Ramanathan Kumaran, Danielson Bengt: Principles and applications of thermal biosensors. Biosens. Bioelectron 200I, 16, 4I7-423I4.
14. Zheng YH., LiuJ., Ma YZ., Xu Y., Xu F., Hua TC,: Temperature effects on enzyme activity of chicken liver esterase used in calorimetric biosensor. Artif. Cells. Blood Substit. Immobil. Biotechnol 20I2, 40, I25-3I.
15. Geschwindner S., Carlsson J.F, Knecht W.: Application of Optical Biosensors in Small-Molecule Screening Activities. Sensors 20I2, 12, 43II-4323.
16. Fan X., White I.M., Shopova S.I., Zhu H., Suter J.D., Sun Y: Sensitive optical biosensors for unlabeled targets: A revie. Anal. Chim. Acta 2008, 620, 8-I6.
17. Long F, Zhu A., Shi H.: Recent Advances in Optical Biosensors for Environmental Monitoring and Early Warning. Sensors 20I3, I3(I0), I3928-I3948.
18. Homola J.: Present and Future of surface plasmon resonance biosensors. Anal. Bio-alnal. Chem. 2003, 377, 528-539.
19. Homola J., Vaisocherova H., Dostalek J., Piliarik M.: Multi-analyte surface plasmon resonance biosensing. Methods 2005, 37, 26-36.
20. Helmerhorst E., Chandler D.J., Nussio M., Mamotte C.D.: Real-time and label-free bio-sensing of molecular interaction by Surface Plasmon Resonance: a laborato-ryMedicineperspective. Clin. Biochem. Rev. 20I2, 33, I6I-I73.
21. Robinson M., Kuncova-Kallio J., Grangvist N., Sadowski J.W.: Multi-Parametric Surface Plasmon Resonance - A new technique to determine thickness and refrac-tiveindexofthinandthicklayers. Nanotech. 20I2, I, 42-44.
22. Zhao J., Zhang X., Yonzon C.R., Haes A.J., Van Duyne R.P: Localized surface plasmon resonance biosensors. Nanomedicine 2006, 1(2), 219-228.
23. Steiner G., Sablinskas V, Hubner A., Kune Ch., Salzer R.: Surface plasmon resonance imaging of microstructured monolayers. J. Mol. Structure 1999, 509, 265-273.
24. Homola J.: Surface plasmon resonance based sensors. Springer Series on Chemical Sensors and Biosensor Springer-Verlag 2006, vol 4, 26-34.
25. Steiner G.: Surface plasmon resonance imaging. Anal. Bioanal. Chem. 2004, 379, 328-331.
26. Gorodkiewicz E., Sankiewicz A., Laudański P: Surface plasmon resonance imaging biosensors for aromatase based on a potent inhibitor and a specific antibody: Sensor development and application for biological material. Cent. Eur. J. Chem. 2014, 12(5), 557-587.
27. Abbas A., Linman n M.J., Cheng: New New trends in instrumental design for surface plasmon resonance-based biosensors. Biosens. Bioelectron 2011, 26(5), 1815-1824.
28. Sassolas A., Blum L.J., Leca-Bouvier B.D.: Immobilization strategies to develop enzymatic biosensors. Biotechnol. Adv. 2012, 30, 489-511.
29. Homola J.: Surface plasmon resonance sensors for detection of chemical and biological species. Chem. Rev. 2008, l08(2),462-469.
30. Shabani Arghavan, Tabrizian Maryam: Design of a universal biointerface for sen-sitive, selective, and multiplex detection of biomarkers using surface plasmon resonance imaging. Analyst 2013, 138, 6052-6062.
31. Ladd J., Taylor A.D., Piliarik M., Homola J., Jiang S.: Label-free detection of can-cer biomarker candidates using surface plasmon resonance imaging. Anal. Bioanal. Chem. 2009, 393, 1157-1163.
32. Piliarik M., Bockova M., Homola J.: Surface plasmon resonance biosensor for pa-rallelized detection of protein biomarkers in diluted blood plasma. Biosens. Bioelectron. 2010, 26, 1656-1661.
33. Ktari T, Baccar H., Mejri M.B., Abdelghani A.: Calibration of Surface Plasmon Resonance Imager for Biochemical Detection International Journal of Electrochemistry. 2012, Article ID 421692, 5 pages, http://dx.doi.org/l0.ll55/20l 2/421692.
34. Dorokhin D., Haasnoot W, Franssen M.C.R., Zuilhof H., Nielen M.W.F: Imaging surface plasmon resonance for multiplex microassay sensing of mycotoxins. Anal. Bioanal. Chem. 20ll, 400(9), 3005-30ll.
35. Rebe R.S., Liu H., Norde W. Bremer M.G.: Foodallergensprofiling with an imaging surface plasmon resonance-based biosensor. Anal. Chem. 20l0, 82(20),
8485-849l.
36. Rebe R.S. Bremer M.G., Haasnoot W., Norde W.: Label-free and multiplex detection of antibiotic residues in milk using imaging surface plasmon resonance-based immunosensor. Anal. Chem. 2009, 81(18), 7743-7749.
37. Gobi K.V, Tanaka H., Shoyama Y, Miura N.: Highlysensitive regenerable immunosensor for label-free detection of 2,4-dichlorophenoxyacetic acid at ppb levels by using surface plasmon resonance imaging. Sensors and Actuators B, 2005, 111-112, 562-57l.





















KOMENTARZE (0)
Do artykułu: Bioczujniki SPRI - narzędzie diagnostyczne przyszłości